正确率40.0%如表实验不能达到预期实验目的是()
| 序号 | 实验操作 | 实验目的 |
| $${{A}}$$ | 在浓硫酸和稀硫酸中分别加入 $${{C}{u}}$$ 片,加热 | 比较稀 $${、}$$ 浓硫酸氧化性强弱 |
| $${{B}}$$ | $$\mathrm{F_{2} \,, \ C l_{2}}$$ 分别与 $${{H}_{2}}$$ 反应 | 比较氟 $${、}$$ 氯的非金属性强弱 |
| $${{C}}$$ | 把 $${{C}{{O}_{2}}}$$ 通入到水玻璃中 | 比较碳 $${、}$$ 硅的非金属性强弱 |
| $${{D}}$$ | 向 $$\mathrm{M g C l_{2} \, \wedge\, \ A l C l_{3}}$$ 溶液中分别通入 $${{N}{{H}_{3}}}$$ | 比较镁 $${、}$$ 铝金属性强弱 |
D
A.$${{A}}$$
B.$${{B}}$$
C.$${{C}}$$
D.$${{D}}$$
2、['浓硫酸的强氧化性', '化学反应的实质', '氧化还原反应的规律', '硝酸的强氧化性', '硫酸的性质', '钠与氧气等非金属的反应', '化学反应条件的控制', '化合价的变化规律', '铁离子、铁盐', '铜']正确率40.0%下列各组物质:$${①{C}{u}}$$与$${{H}{N}{{O}_{3}}}$$溶液$${②{C}{u}}$$与$${{F}{e}{C}{{l}_{3}}}$$溶液$${③{Z}{n}}$$与$${{H}_{2}{S}{{O}_{4}}}$$溶液$${④{F}{e}}$$与盐酸$${⑤{N}{a}}$$与$${{O}_{2}}$$.由于条件不同而能发生不同氧化还原反应的是()
B
A.只有$${③{④}}$$
B.只有$${①{③}{⑤}}$$
C.只有$${①{②}}$$
D.只有$${①{③}{④}{⑤}}$$
3、['化学键的概念及类别', '化学反应条件', '离子键的形成、概念', '电离方程式', '对物质分类的考查', '酸、碱、盐、氧化物的概念及其分类', '化学反应条件的控制', '共价键的形成、概念']正确率40.0%下列对化学知识的认识正确的是$${{(}}$$$${{)}}$$
C
A.金属氧化物均属于碱性氧化物
B.化合物与金属氧化物属于交叉关系
C.熔融状态下能导电的化合物一定含离子键
D.氯化钠溶于水发生电离,电离方程式为:$$\mathrm{N a C l} \stackrel{\boxplus\#} {=} \mathrm{N a}^{+}+\mathrm{C l}^{-}$$
4、['实验原理、相关方程式的书写', '化学反应条件的控制']正确率60.0%svg异常
B
A.“还原”过程需要在高温条件下进行,该反应的主要还原产物为$${{S}{i}}$$
B.为最大程度节约成本,上述生产工艺中能循环使用的物质只有$${{H}_{2}}$$
C.为防止$$\mathrm{S i H C l}_{3}$$水解而损失、氢气爆炸,“氧化”“分离”与“热解”的过程均需要在无水、无氧的条件下进行
D.“氧化”过程反应的化学方程式为$$\mathrm{S i+3 H C l}$$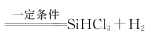
正确率40.0%svg异常
D
A.实线表示溶液浊度随时间的变化
B.$${{5}{0}{s}}$$时向溶液中滴入酚酞试液,溶液变红
C.该实验是在常温下进行的
D.$${{1}{5}{0}{s}}$$后浑浊度下降是因为生成的$$\mathrm{M g ( O H )_{2}}$$沉降
正确率40.0%$${{N}{O}}$$和$${{C}{O}}$$都是汽车尾气里的有害物质,它们能缓缓地反应生成$${{N}_{2}}$$和$${{C}{{O}_{2}}}$$,化学方程式为:,对此反应,下列叙述错误的是()
D
A.使用正催化剂能加大反应速率
B.改变反应物的压强对反应速率产生影响
C.冬天气温低,反应速率降低,对人体危害更大
D.无论外界条件怎样改变,均对此化学反应的速率无影响
7、['钠与氧气等非金属的反应', '化学反应条件的控制', '氢氧化钠']正确率60.0%下列各组中的两物质相互反应时,与反应条件和用量无关的是()
B
A.$${{N}{a}}$$和$${{O}_{2}}$$
B.$${{F}{e}}$$和$${{F}{e}{C}{{l}_{3}}}$$
C.$${{C}{{O}_{2}}}$$和$${{N}{a}{O}{H}}$$
D.$${{A}{l}{C}{{l}_{3}}}$$和$${{N}{a}{O}{H}}$$
8、['常见的基本实验操作', '实验方案的设计与评价', '实验药品、实验装置/实验步骤的作用', '乙酸的酯化反应', '平衡转化率的计算及变化', '物质制备的探究', '化学反应条件的控制', '影响化学平衡的因素', '物质分离、提纯的常见物理方法']正确率60.0%有关实验室制备乙酸乙酯和乙酸丁酯的描述错误的是()
D
A.两反应均需使用浓硫酸$${、}$$乙酸
B.过量乙酸可提高$${{1}{−}}$$丁醇的转化率
C.制备乙酸乙酯时乙醇应过量
D.提纯乙酸丁酯时,需过滤$${、}$$洗涤等操作
9、['浓硫酸的强氧化性', '氧化反应', '实验方案的设计与评价', '铁离子、亚铁离子的检验、鉴别', '影响化学反应速率大小的因素', '可逆反应', '葡萄糖的检验', '化学反应条件的控制', '钝化原理及应用', '实验现象的描述或解释']正确率40.0%根据下列实验操作和现象能得出相应结论的是()
| 选项 | 实验操作和现象 | 结论 |
| $${{A}}$$ | 向一定浓度 $${{C}{u}{S}{{O}_{4}}}$$ 溶液中通入 $${{H}_{2}{S}}$$ 气体,出现黑色沉淀 | $${{H}_{2}{S}}$$ 酸性比 $${{H}_{2}{S}{{O}_{4}}}$$ 强 |
| $${{B}}$$ | 向 $$2 \mathrm{m L 2 7_{0} C u S O_{4}}$$ 溶液中加入几滴 | $${Ⅹ}$$ 不可能是葡萄糖 |
| $${{C}}$$ | 常温下,相同铝片分别投入足量稀 $${、}$$ 浓硫酸中 | 反应物浓度越大,反应速率越大 |
| $${{D}}$$ | 取 $${{5}}$$ $${{m}{L}}$$ $${{0}{.}{1}}$$ $$\mathrm{m o l} \cdot\mathrm{L}^{-1} \mathrm{K I}$$ 溶液,加入 $${{1}}$$ $${{m}{L}}$$ $${{0}{.}{1}}$$ $$\mathrm{m o l} \cdot\mathrm{L}^{-1} \mathrm{F e C l}_{3}$$ 溶液,萃取分液后,向水层滴入 $${{K}{S}{C}{N}}$$ 溶液,溶液变成血红色 | $$\mathrm{F e}^{3+}$$ 与 $${{I}^{−}}$$ 所发生的反应为可逆反应 |
D
A.$${{A}}$$
B.$${{B}}$$
C.$${{C}}$$
D.$${{D}}$$
10、['醛类与新制氢氧化铜悬浊液的反应', '醇的催化氧化', '卤代烃的取代反应', '醇的消去反应', '羧酸的酯化反应', '有机合成路线的设计与实施', '有机反应类型', '化学反应条件的控制', '氢氧化钠', '常见官能团的名称、组成及结构', '烯烃的加成反应', '醛类的银镜反应']正确率40.0%svg异常
B
A.$$\mathrm{b d f g h}$$
B.$$\operatorname{e d c a h}$$
C.$$\operatorname{a e d c h}$$
D.$$\mathrm{b a e c f}$$
1. 解析:
选项 $$D$$ 的实验操作是向 $$MgCl_2$$ 和 $$AlCl_3$$ 溶液中通入 $$NH_3$$,目的是比较镁和铝的金属性强弱。然而,$$NH_3$$ 是弱碱,无法完全沉淀 $$Al^{3+}$$,且金属性强弱通常通过单质与酸或水的反应剧烈程度来判断,而非通过盐溶液的沉淀反应。因此,该实验无法达到预期目的。其他选项的实验设计均合理。
答案: $$D$$
2. 解析:
① $$Cu$$ 与 $$HNO_3$$ 溶液:浓 $$HNO_3$$ 生成 $$NO_2$$,稀 $$HNO_3$$ 生成 $$NO$$,反应产物不同。
② $$Cu$$ 与 $$FeCl_3$$ 溶液:无论条件如何,反应均为 $$Cu + 2Fe^{3+} \rightarrow Cu^{2+} + 2Fe^{2+}$$。
③ $$Zn$$ 与 $$H_2SO_4$$ 溶液:稀 $$H_2SO_4$$ 生成 $$H_2$$,浓 $$H_2SO_4$$ 生成 $$SO_2$$,反应产物不同。
④ $$Fe$$ 与盐酸:无论条件如何,反应均为 $$Fe + 2H^+ \rightarrow Fe^{2+} + H_2$$。
⑤ $$Na$$ 与 $$O_2$$:常温生成 $$Na_2O$$,加热生成 $$Na_2O_2$$,反应产物不同。
因此,①③⑤因条件不同而发生不同反应。
答案: $$B$$
3. 解析:
A. 错误,金属氧化物不一定是碱性氧化物(如 $$Al_2O_3$$ 是两性氧化物)。
B. 错误,化合物包含金属氧化物,二者是包含关系而非交叉关系。
C. 错误,熔融导电的化合物可能是离子化合物或某些共价化合物(如 $$AlCl_3$$)。
D. 正确,$$NaCl$$ 溶于水电离为 $$Na^+$$ 和 $$Cl^-$$,但电离方程式无需标注条件。
答案: $$D$$
6. 解析:
D 选项错误。化学反应速率受温度、压强、催化剂等外界条件影响。A、B、C 均正确描述了外界条件对反应速率的影响。
答案: $$D$$
7. 解析:
B 选项 $$Fe$$ 与 $$FeCl_3$$ 反应生成 $$FeCl_2$$,与条件和用量无关。其他选项(如 $$Na$$ 与 $$O_2$$、$$CO_2$$ 与 $$NaOH$$、$$AlCl_3$$ 与 $$NaOH$$)均受条件或用量影响。
答案: $$B$$
8. 解析:
C 选项错误。制备乙酸乙酯时,乙酸应过量以提高乙醇的转化率,而非乙醇过量。
答案: $$C$$
9. 解析:
D 选项正确。$$Fe^{3+}$$ 与 $$I^-$$ 反应后,水层中 $$Fe^{3+}$$ 剩余(通过 $$KSCN$$ 检验),说明反应可逆。A 选项错误($$H_2S$$ 酸性弱于 $$H_2SO_4$$),B 选项错误(未加热可能因条件不足),C 选项错误(浓 $$H_2SO_4$$ 会使铝钝化)。
答案: $$D$$
.jpg)